| 产品名称 : | Annexin V-Alexa Fluor 488/Dead Cell Apoptosis Detection Kit |
| 产品品牌 : | HYCEZMBIO® |
| 规格: | 50T |
Annexin V-Alexa Fluor 488/PI 细胞凋亡检测试剂盒
产品介绍:
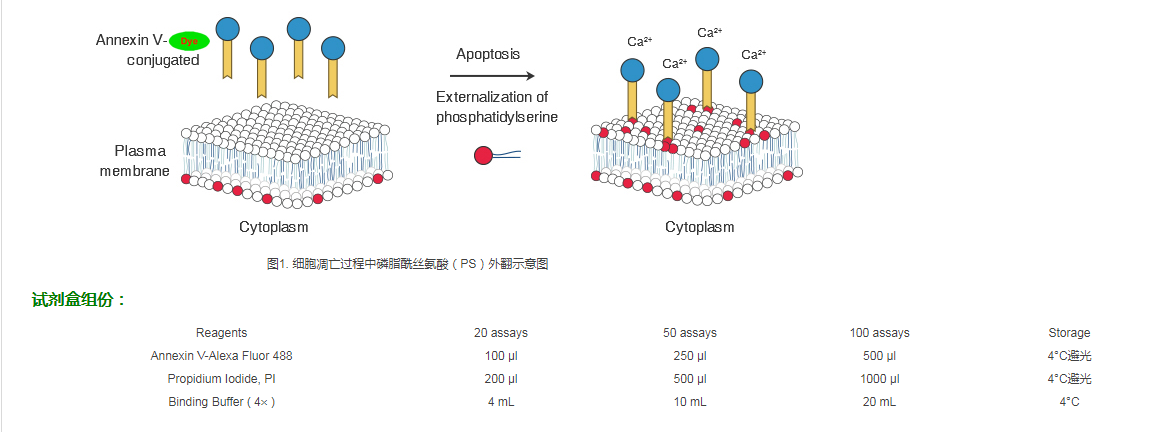
磷脂酰丝氨酸(PS)是一种带负电荷的磷脂,正常细胞中,PS只分布在细胞膜脂质双层的内侧,而在细胞凋亡早期,细胞膜 PS由脂膜内侧翻向细胞膜外侧,使PS暴露在细胞膜外表面。Annexin V是一种分子量为35~36kD的Ca2+依赖性磷脂结合蛋白,与磷脂酰丝氨酸有高度亲和力,故可通过细胞外侧暴露的磷脂酰丝氨酸与凋亡早期细胞的胞膜结合。因此Annexin V被公认为检测细胞早期凋亡的灵敏指标之一。
将Annexin V进行红色荧光Alexa Fluor 488标记,以标记了的Annexin V作为探针,利用荧光显微镜或流式细胞仪可检测细胞凋亡的发生。碘化丙啶(Propidium Iodide, PI)是一种核酸染料,它不能透过正常细胞或早期凋亡细胞的完整的细胞膜,但对凋亡中晚期的细胞和坏死细胞,PI能够透过细胞膜而使细胞核染红。因此采用Annexin V与PI双染的方法,就可以将处于不同凋亡时期的细胞区分开来。在双变量流式细胞仪的散点图上,左下象限显示活细胞,右下象限为早期凋亡细胞,右上象限是凋亡晚期细胞和坏死细胞。
所需实验器材:
微量移液器;PBS; 不含EDTA的胰酶消化液; 低速离心机; 流式细胞仪
注意事项:
1) 此试剂盒仅供研究使用。
2) 微量试剂需离心数秒将试剂收集至管底后再开盖取用。
3) Propidium Iodide(PI)有毒,操作时要带手套,使用时避免与皮肤,眼睛和黏膜接触。
4) Annexin V-Alexa Fluor 488中含有剧毒成分叠氮化钠(NaN3), 操作时要带手套,使用时避免与皮肤,眼睛和黏膜接触。
5) 本试剂盒用于检测活细胞,流式细胞仪检测时,细胞数量不应低于1x106。
6) 染色后宜尽快检测,时间过长可能会导致凋亡或坏死细胞的数量增加。
7) Annixin V检测凋亡细胞的方法适用于悬浮生长的细胞,如:淋巴细胞等细胞的检测。对于贴壁生长的细胞,由于在胰酶等消化处理过程中会造成细胞膜的损伤,会造成较高的假阳性,而用细胞刮子会造成细胞粘连成团,而影响检测,可将胰酶消化后的细胞保存在含2%BSA的PBS中,防止进一步的损伤。尽管目前,包括国外也有一些单位采用该方法检测贴壁生长的细胞。我不推荐用该方法检测。因为其重复性较差,且需要操作时非常小心。
8) 消化贴壁细胞残留的胰酶会消化并降解Annexin V-Alexa Fluor 488,最终导致染色失败。
9) 细胞固定后可能导致荧光的淬灭,请不要固定样品。
操作说明:
1. 细胞样品的准备:
a) 悬浮细胞:
1) 收集细胞至离心管中1000-2000rpm离心5min,小心去除上清。
2) 用1ml 4℃预冷PBS轻轻重悬细胞并计数,1000-2000rpm离心5min,小心吸除上清。
3) 再加入1ml 4℃预冷的PBS重悬细胞,1000-2000rpm离心5min,小心吸除上清。
b) 贴壁细胞:
1)吸出细胞培养液至离心管中,PBS洗涤贴壁细胞一次,加入适量不含EDTA的胰酶细胞消化液消化细胞。
2)室温孵育至轻轻吹打可以使贴壁细胞吹打下来时,吸除胰酶细胞消化液。需避免胰酶的过度消化。
3)加入步骤i中收集的细胞培养液,稍混匀,转移到离心管内,1000-2000rpm离心5min,小心吸除上清。
注:加入步骤i中的细胞培养液一方面可以收集已经悬浮的发生凋亡或坏死的细胞,另一方面细胞培养液中的血清可以有效抑制或中和残留的胰酶;残留的胰酶会消化并降解后续加入的Annexin V- Alexa Fluor 488导致染色失败。
4)用1ml 4℃预冷PBS轻轻重悬细胞并计数,1000-2000rpm离心5min,小心吸除上清。
5)再加入1ml 4℃预冷的PBS重悬细胞,1000-2000rpm离心5min,小心吸除上清。
2. 用去离子水按1:4稀释Binding Buffer(4ml Binding Buffer+12ml去离子水);
3. 用250ml结合缓冲液重新悬浮细胞,调节其浓度为1×106/ml;
4. 取100ml的细胞悬液于5 ml流式管中,加入Annexin V- Alexa Fluor 488,轻轻混匀;
5. 室温(20-25℃)避光孵育10min;
6. 上机前5min加入10ml 碘化丙啶溶液,轻轻混匀;
7. 上机前在反应管中补加400ml PBS重悬细胞, 避光保存, 随即进行流式细胞仪(FACS)检测, Annexin V- Alexa Fluor 488和PI均为红色荧光。
Fig 1. Flow cytometry detects early apoptotic cells. The cells in the lower right quadrant are the early apoptotic cells, and the upper right quadrant is apoptosis terminal cell and necrotic cell.
